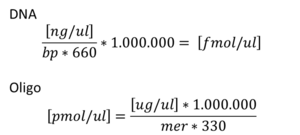Samples preparation for sequencing
Instruction and formulas
PCR Products
Setup a mix in total volume 10ul with:
PCR products = [15fmol/ul] final
Oligo for sequencing = [4.5pmol/ul] final
Plasmidic DNA
Setup a mix in total volume 10ul with:
DNA = [25fmol/ul] final
Oligo for sequencing = [1.25pmol/ul] final
BAC-End sequencing
Setup two vials:
DNA template 3–5 μg BAC DNA ultrapure in ≤6ul
Primer 5ul [15 pmol/ul]
Genotyping
Info for samples preparation: fragments analysis (microsatellites) RFLP - AFLP
Oligos prepatration:
Lenght: max 25 mer; max 60% GC.
Up to four different fluorescent dyes may be used for labeling:
6FAM – VIC – NED – PET
allowing for a greater amount of multiplexing in a single lane for higher throughput. An internal size standard, labeled with a fifth dye, provides accurate and reproducible size determination and quantification, and eliminates problems associated with lane-to-lane or run-to-run electrophoretic variability. The service need to know the fragment maximun lenght to read to use the appropriate Size standard. Maximun lenght allowed 590bp
SNiPs
For SNiPs analysis we support the SNaPshot multiplex kit (Life Technologies).
SNaPshot Multiplex Protocol .pdf
Documento Adobe Acrobat [625.5 KB]
Formule utili/useful formulas
PURIFICAZIONE E CONSEGNA DEL TEMPLATO:
DNA PLASMIDICO
La qualita’ del DNA plasmidico ottenuto da colture batteriche che hanno raggiunto la fase stazionaria non e’ ottimale. Per le colture cresciute a 370C e’ consigliabile bloccare la crescita batterica ad una O.D.600 non maggiore di 1,5. Una semplice alternativa e’ quella di incubare gli inoculi a 300C O.N.
La preparazione del DNA plasmidico deve essere effettuata mediante l’uso di colonne a scambio ionico che forniscono il miglior grado di purificazione.
Si consiglia l’uso di:
Qiagen Plasmid Mini, Midi, Maxi, Mega, Giga Kit
Qiagen QIAprep Spin Miniprep Kit
Si raccomanda di utilizzare non piu’ della meta’ del volume dell’inoculo consigliato nel manuale d’uso delle colonne.
Il campione deve essere quantizzato spettrofotometricamente ed il rapporto 260/280 deve essere maggiore od uguale a 1.8.
E’ necessaria la documentazione fotografica del campione consegnato con marker quantitativo (si consiglia 1 ml di l HindIII [500 ng/ml]).
Si richiede una mix: DNA plasmidico [25 fmol/µl] in H2O + primer [1,25 pmol/µl] in H2O, in un volume totale di 10 µl per sequenza,. in eppendorf tube da 1.5 ml. Si consiglia di partire da una concentrazione del campione e del primer di rispettivamente [100 ng/µl] e [5 pmol/µl].
Si prega di etichettare chiaramente sulla provetta il nome del campione (max quattro caratteri) e del primer (max quattro caratteri).
P. S.: per calcolare i µl di plasmide da utilizzare nella mix (10 µl):
µl = 0,165 x (bp) / [ng/µl]
PRODOTTI DI PCR
La purificazione dei prodotti di PCR deve essere effettuata mediante l’uso di colonnine o da gel.
Si consiglia l’uso di:
Qiagen QiaQuick Spin PCR purification Kit.
Qiagen QiaQuick Gel extraction Kit.
Il campione deve essere quantizzato spettrofotometricamente ed il rapporto 260/280 deve essere maggiore od uguale a 1.8.
E’ necessaria la documentazione fotografica del campione consegnato con marker quantitativo (si consiglia 1 ml di l HindIII [500 ng/ml]).
Per frammenti di PCR di lunghezza superiore alle 1'500 bp si prega di contattare il Servizio.
Si richiede una mix: frammento di DNA [15 fmol/µl] in H2O + primer [4,5 pmol/µl] in H2O, in un volume totale di 10 µl per sequenza,.in eppendorf tube da 1.5 ml. Si consiglia di partire da una concentrazione del campione e del primer di rispettivamente [10 ng/µl] e [20 pmol/µl].
Per i prodotti di PCR e’ preferibile l’uso di primers interni.
Si prega di etichettare chiaramente sulla provetta il nome del campione (max quattro caratteri) e del primer (max quattro caratteri).
P. S.: per calcolare i µl di frammento da utilizzare nella mix (10 µl):
µl = 0,1 x (bp) / [ng/µl]
PRIMERS
E’ preferibile che:
la TM dell’oligo sia maggiore di 50°C; la sequenza non contenga piu’ di quattro basi uguali successive, specialmente se G o C; che il 3’ sia stabile, e che non possegga zone di complementarieta’; che il contenuto di G/C sia di circa il 50% e che la lunghezza sia compresa tra 21 e 26 basi.
Presso il Servizio sono disponibili i seguenti primers:
T3 (19 mer): 5'- ATT AAC CCT CAC TAA AGG G -3'
T7 (19 mer): 5'- AAT ACG ACT CAC TAT AGG G -3'
Sp6 (19mer): 5'- GAT TTA GGT GAC ACT ATA G -3'
M13 fw(21 mer): 5'- CGT TGT AAA ACG ACG GCC AGT -3'
M13 rv (24 mer): 5'- TTT CAC ACA GGA AAC AGC TAT GAC -3'
Si prega di controllare che la sequenza dell’oligo coincida perfettamente con quella del plasmide.
Real Time qPCR
REAL TIME qPCR SERVICE
The Molecular Biology Service is equipped with a high throughput instrument for the Real Time qPCR. Such instrumentation uses 384 well plates which not only allows to analyze an high number of samples in the same run but also to reduce the reaction volumes resulting in a reduced cost per reaction. To use such technology is necessary to book on the SBM web pages (www.sbmweb.it). In every working day there are four available runs qPCR according to the following calendar
Turno 1 starting run at 9:30
Turno 2 starting run at 10:45
Turno 3 starting run at 12:00
Turno 4 starting run at 13:15
Turno 5 starting run at 14:30
Turno 6 starting run at 15:45
Turno 7 starting run at 17:00
We thank you to avoid consecutive bookings if possible.
The instrument can directly be used by the user using the following "quick setup and run guidelines". We recommends for the first time to ask instructions to the SBM staff. Reaction volumes and thermal profile suggested and validated by the SBM with the available chemistry are reported.
Quick setup and run guidelines
Setup plates according to the “standard SBM protocol”
|
Add Order |
Sample |
|
|
1° |
SYBR Master Mix |
5,0 ul |
|
2° |
Oligo F + Oligo R [0,7 pmol/ul] each |
4,0 ul |
|
3° |
cDNA |
1,0 ul |
|
|
V tot. |
10,0 ul |
Reaction plates will be analyzed according to the standard or Fast SBM thermal profile
Thermal profiles
|
Standard SYBR (duration ≈1 h 50 min) |
Fast SYBR (duration ≈ 50 min) |
||||||
|
Step 1 |
95°-10 min |
|
Step 1 |
95°-10 min |
|
||
|
Step 2 |
|
|
Step 2 |
|
|
||
|
Step 4 |
60 °- 1 min |
39 times |
Step 4 |
60 °-20 sec |
|
||
|
Go to |
2 |
|
Go to |
2 |
39 times |
||
|
Step 6 |
Melting |
60°-95° |
Step 6 |
Melting |
|
||
Setup and run:
- Power on the instrument with the button on the back left side
- Press the red button in the lower right corner of the touch screen. From the right side of the instrument the plate loader tray will appear
- Place the plate in the right orientation (A1 in the upper left corner) properly on the tray.
- Press again on the touch screen the red lower right corner button to load the plate
- On the main screen in the “my shortcuts” section press, according to the SYBR you are using:
“SBM_SYBR_delta_delta_ct_standard_10ul_no_rox” for standard SYBR without ROX
“SBM_SYBR_delta_delta_ct_FAST_10ul_rox” for Fast SYBR with ROX
“SBM_SYBR_delta_delta_ct_FAST_10ul_no_rox” for standard SYBR without ROX
- in the “notes” section insert your name using the touch keybord that will appear
- press “start run now”
Downloading the result file:
- Be sure that the run is completed (check run time)
- In the main window of the touch screen press “collect results”
- Insert the USB memory stick in the left side of the touch screen
- select the appropriate run file
- press “copy to USB”
RealTime VIIA7 info ing_3_3_14.pdf
Documento Adobe Acrobat [424.9 KB]
Sample QC
BIOANALYZER
Bioanalyzer Application compendium.pdf
Documento Adobe Acrobat [4.6 MB]